断熱過程のエントロピー変化を別経路で計算してみる
準静的な断熱過程のエントロピー変化(=0) を、別の過程経由(下記)で計算して確認する。
・等温過程 → 定圧過程
・等温過程 → 定積過程
・定圧過程 → 定積過程
考えるのは断熱膨張でも断熱圧縮でもよいが、どちらかに決めておいた方が図が描きやすいので膨張とする。
変数として、温度 T、圧力 p、体積 V、質量 m、気体定数 R、定積比熱 cv、定圧比熱 cp、比熱比 κ、内部エネルギー U、熱量 q を用いる。
x の対数を ln(x) と表記する。
最初の状態を 状態1、最後の状態を状態2、途中の過程が切り替わる状態を状態3 とし、変数の添字に用いる。
よって、T1 > T2、p1 > p2、V1 < V2、S1→2 = 0 である。
等温過程 → 定圧過程
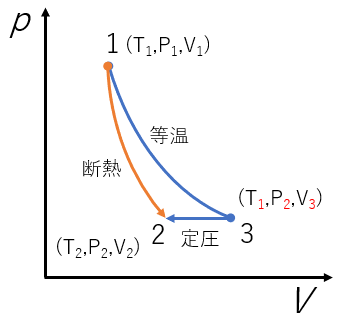
1. 等温過程 (T1、状態1→状態3)
ボイルシャルルの法則より
p = p1V1 / V
等温過程なので
dU = 0
d'q = dU + pdV = pdV
S1→3 = ∫d'q / T1
= 1 / T1 × ∫p dV (区間 V1~V3)
= p1V1 / T1 × ∫1 / V dV (区間 V1~V3)
= p1V1 / T1 ln (V3 / V1)
気体の状態方程式から、
p1V1 / T1 = mR
よって S1→3は、
S1→3 = mR ln (V3 / V1)
ところで、断熱過程(状態1→状態2) ではポアソンの法則から次式が成り立つ。
(T1 / T2) κ/(κ-1) = (p1 / p2)
状態1→状態3 でボイルシャルルの法則から、
V3 / V1 = p1 / p2
よって、
V3 / V1 = (T1 / T2) κ/(κ-1)
よって S1→3は、
S1→3 = mR ln (T1 / T2) κ/(κ-1)
= mR・κ/(κ-1)・ln (T1 / T2)
定圧比熱 cp と定積比熱 cp の関係式 cp = cv + R = κ cv から、
cp = R κ / (κ - 1)
よって S1→3は、
S1→3 = m cp ln (T1 / T2)
2. 定圧過程 (p2、状態3→状態2)
ボイルシャルルの法則より
V = (V2 / T2)・T
dV = (V2 / T2)・dT
d'q = dU + p dV
= m cv dT + p2 dV
= m cv dT + p2V2 / T2 dT
気体の状態方程式から、
p2V2 / T2 = mR
よって d'q は、
d'q = m (cv + R) dT
S3→2 = ∫d'q / T
= m (cv + R) ∫dT / T (区間 T1~T2)
= m (cv + R) ln (T2 / T1)
マイヤーの公式より、cp = R + cv なので、
S3→2 = m cp ln (T2 / T1)
3. 和
S1→2 = S1→3 + S3→2
= m cp ln (T1 / T2) + m cp ln (T2 / T1)
= 0
等温過程 → 定積過程
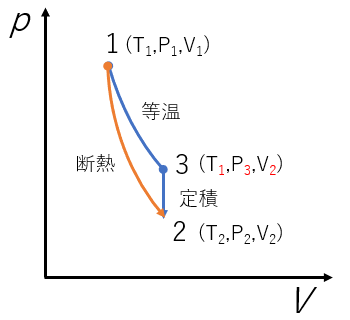
1. 等温過程 (T1、状態1→状態3)
ボイルシャルルの法則より
p = p1V1 / V
等温過程なので
dU = 0
d'q = dU + pdV = pdV
S1→3 = ∫d'q / T1
= 1 / T1 × ∫p dV (区間 V1~V2)
= p1V1 / T1 × ∫1 / V dV (区間 V1~V2)
= p1V1 / T1 ln (V2 / V1)
気体の状態方程式から、
p1V1 / T1 = mR
よって S1→3は、
S1→3 = mR ln (V2 / V1)
2. 定積過程 (V2、状態3→状態2)
定積過程なので
p dV = 0
d'q = dU + pdV = dU
= m cv dT
S3→2 = ∫d'q / T
= m cv ∫dT / T (区間 T1~T2)
= m cv ln (T2 / T1)
ところで、断熱過程(状態1→状態2) ではポアソンの法則から次式が成り立つ。
(T2 / T1) = (V1 / V2) κ-1
よって S3→2は、
S3→2 = m cv ln (V1 / V2) κ-1
= m cv (κ-1) ln (V1 / V2)
定圧比熱 cp と定積比熱 cp の関係式 cp = cv + R = κ cv から、
R = cv(κ - 1)
よって S3→2は、
S3→2 = mR ln (V1 / V2)
3. 和
S1→2 = S1→3 + S3→2
= mR ln (V2 / V1) + mR ln (V1 / V2)
= 0
定圧過程 → 定積過程
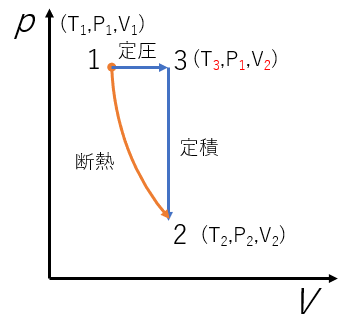
1. 定圧過程 (p1、状態1→状態3)
気体の状態方程式より、
p1 dV = m R dT
dV = (m R / p1) dT
d'q = dU + p1 dV
= m cv dT + p1 (m R / p1) dT
= m (cv + R) dT
S1→3 = ∫d'q / T
= m (cv+R) ∫dT / T (区間 T1~T3)
= m cp ln (T3 / T1)
ボイルシャルルの法則より、
T3 / T1 = V2 / V1
よって S1→3は、
S1→3 = m cp ln (V2 / V1)
2. 定積過程 (V2、状態3→状態2)
定積過程なので、
p dV = 0
d'q = dU + p dV = dU
= m cv dT
S3→2 = ∫d'q / T
= m cv ∫dT / T (区間 T3~T2)
= m cv ln (T2 / T3)
ボイルシャルルの法則より、
T2 / T3 = p2 / p1
よって S3→2は、
S3→2 = m cv ln (p2 / p1)
ところで、断熱過程(状態1→状態2) ではポアソンの法則から次式が成り立つ。
(p2 / p1) = (V1 / V2) κ
よって S3→2は、
S3→2 = m cv ln (V1 / V2) κ
= m κ cv ln (V1 / V2)
= m cp ln (V1 / V2)
3. 和
S1→2 = S1→3 + S3→2
= m cp ln (V2 / V1) + m cp ln (V1 / V2)
= 0
まとめ
エントロピー以外に、熱量・仕事・内部エネルギーを含めた表。
式は、T3、p3、V3 が消える形に整理している。
| 過程 | 熱量 Q | 仕事 W | 内部エネルギー ΔU | エントロピー ΔS | |
| 断熱過程 (1→2) | 0 | m cv (T1 - T2) | m cv (T2 - T1) | 0 | |
| 等温過程 ↓ 定圧過程 |
等温過程 (1→3) | m cp T1 ln (T1 / T2) | m cp T1 ln (T1 / T2) | 0 | m cp ln (T1 / T2) |
| 定圧過程 (3→2) | m cp (T2 - T1) | m R (T2 - T1) | m cv (T2 - T1) | m cp ln (T2 / T1) | |
| 等温過程 ↓ 定積過程 |
等温過程 (1→3) | m R T1 ln (V2 / V1) | m R T1 ln (V2 / V1) | 0 | m R ln (V2 / V1) |
| 定積過程 (3→2) | m cv (T2 - T1) | 0 | m cv (T2 - T1) | m R ln (V1 / V2) | |
| 定圧過程 ↓ 定積過程 |
定圧過程 (1→3) | m cp T1 (V2 / V1 - 1) | m R T1 (V2 / V1 - 1) | m cv { (V2 / V1)T1 - T1 } | m cp ln (V2 / V1) |
| 定積過程 (3→2) | m cv { T2 - (V2 / V1)T1 } | 0 | m cv { T2 - (V2 / V1)T1 } | m cp ln (V1 / V2) | |